MDSAP医疗器械单一审核程序(Medical Device Single Audit Program))是由国际医疗器械监管者论坛(IMDRF)的成员共同发起的项目,旨在通过第三方审核机构,对医疗器械生产商进行一次审核即或满足参与国不同的QMS/GMP要求。
通过MDSAP审核的企业和组织,可以借助单一审核进入多元市场。目前该项目已经获得美国食药品监督管理局FDA、加拿大卫生局Health Canada、澳大利亚TGA、巴西卫生局ANVISA和日本厚生劳动省MHLW的认可。 2018年12月起进入加拿大市场必须通过MDSAP。
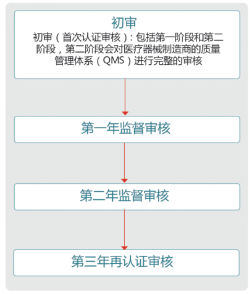
流程图:
通用法规:
澳大利亚
Therapeutic Goods Act1989
Therapeutic Goods(Medical Devices) Regulations2002
巴西
ANVISA Pre-Market Approval RDC 185/2001
ANVISA Good Manufactring Practices RDC 16/2013
ANVISA PMS RDC 67/2009 and RDC 23/2011
加拿大
Food and Drugs Act R.S.C.,1985,C.F-27
CMDR SOR-98-282
美国
Quality System Regulation 21 CFR 820
Medical Device Reporting 21 CFR 803
Reports of Corrections & Removals 21 CF 806
Registration & Listing 21 CFR 807 subparts A to D
Device Tracking 21 CFR 821
日本
MHLW Ministerial Ordinance No.169
官方时间和费用:
官方时间
辅导时间:3-6个月
认证时间:3个月
官方费用
以认证机构的收费为准
相关业务:
MDSAP认证辅导
MDSAP培训