QSR820,又称21CFR820,是美国医疗器械质量管理体系法规的英文缩写。所有在美国或者有产品出口到美国境内的医疗器械企业必须按QSR820的要求建立质量体系。
QSR820是美国(人用)医疗器械制造商以及拟将产品销往美国的外国(人用)医疗器械制造商必须遵守的质量管理体系法规。是多数医疗器械在美国上市之前必须遵守、上市之后随时可能抽查的基本要求。这种抽查即通常所说的FDA工厂检查(医疗器械)。
流程图:
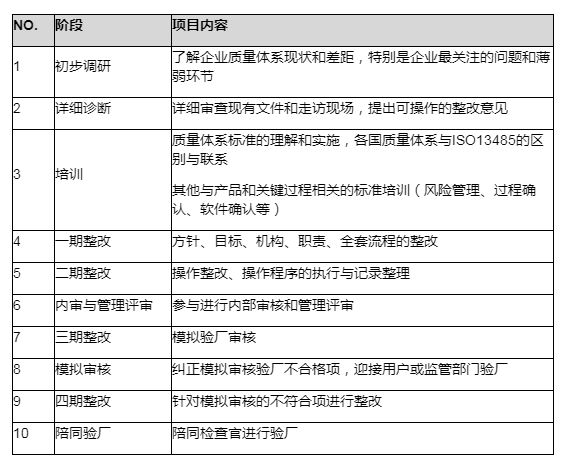
通用法规:
21CFR 820
21CFR801
21CFR803
21CFR806
21CFR810
官方时间和费用:
官方时间
辅导时间:3-6个月
认证时间:提前三个月或一周通知
官方费用
免费
相关业务:
美国FDA 验厂辅导
美国FDA警告信整改
美国FDA QSR820培训