中国国家药品监督管理局(简称NMPA)根据医疗器械风险等级将产品分为第一类,第二类和第三类医疗器械。其中第一类医疗器械实行备案管理,第二类、第三类医疗器械实行注册管理。第二类和第三类医疗器械在获得产品注册证前需通过药监部门的质量管理体系核查,不同的产品类型如无菌医疗器械、植入性医疗器械、体外诊断试剂、定制式义齿和独立软件按相应的《医疗器械生产质量管理规范》相应附录执行。《医疗器械注册证》有效期为5年。
医疗器械进口注册(含一、二、三类医疗器械)应向国家药品监督管理局提交注册申请,同时需提交注册申请人所在国家(地区)主管部门准许该医疗器械上市销售的证明文件。《医疗器械注册证》有效期为5年。
流程图:

通用法规:
《医疗器械监督管理条例》
《医疗器械注册与备案管理办法》
《医疗器械说明书和标签管理规定》
《医疗器械临床试验质量管理规范》
《医疗器械生产监督管理办法》
《医疗器械分类规则》
官方时间和费用:
1、官方费用(单位:万元)
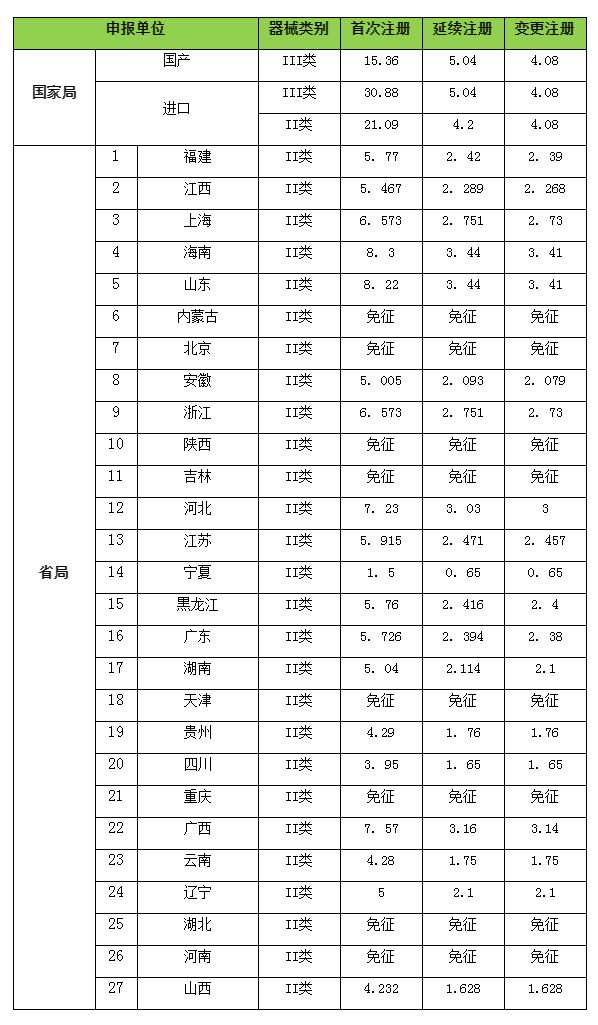
2、时间以官方公布为准
相关业务:
国内/进口I类医疗器械备案
国内/进口II类医疗器械注册
国内/进口III类医疗器械注册