为规范医疗器械唯一标识系统建设,加强医疗器械生命周期管理,国家药监局于2019年年8月发布的《医疗器械唯一标识系统规则》从2019年10月1日起开始施行;
(1)UDI定义
基于标准创建的一系列由数字、字母和/或符号组成的代码,包括产品标识(DI) 和生产标识 (PI) ,用于对医疗器械进行唯一性识别,可用于医疗器械产品的管理和追溯等。(注:“唯一”并不意味对单个产品进行序列化管理)
(2)UDI结构:DI+PI
• DI=Device Identifier
产品标识(静态信息)
制造商及其每种医疗器械都应具有的独立标识,可以对医疗器械品种进行识别。
• PI=Production Identifier
生产标识(动态信息)
与生产过程相关的信息,根据实际应用需求可包含医疗器械序列号、生产批号、生产日期、失效日期等。
(3)发码机构
中国物品编码中心(GS1中国)
中关村工信二维码技术研究院(ZIIOT)
阿里健康科技(中国)有限公司
注:如果只考虑中国市场,可选择以上提及的三家发码机构中的任何一家。若器械的销售市场不局限于国内,发码机构的选择则需兼顾到海外监管部门的要求,例如美国、欧盟,那么只有GS1能同时满足中国、欧盟和美国的要求。
流程图
UDI实施流程(以GS1为例)
1) 熟悉UDI的相关法规;
2) 确认编码机构;
3) 申请注册人备案人识别代码;
4) 确定编码规则,申请DI等相应的编码;
5) 编写PI,生成UDI标签;
6) 上传UDI数据,包括在申请医疗器械注册、注册变更或者办理备案时,在注册/备案管理系统中提交其产品标识(UDI-DI),以及在销售产品之前,上传产品标识和相关数据至中国医疗器械唯一标识数据库(UDID);
7) 建立相关的程序文件来确保整个过程受控可持续。
通用法规
YY/T 1681-2019 医疗器械唯一标识系统基础术语
YY/T 1630-2018 医疗器械唯一标识基本要求
医疗器械唯一标识数据库基本数据集(征求意见)
医疗器械唯一标识数据库填报指南(征求意见)
GB 12904 商品条码零售商品编码与条码表示
GB/T 16830 商品条码储运包装商品编码与条码表示
GB/T 16986 商品条码应用标识符
GB/T 15425 商品条码 128条码
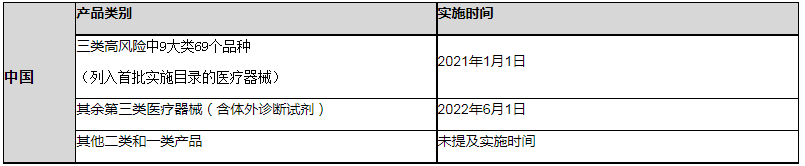
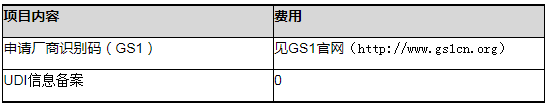
官方时间和费用
实施时间
官方费用
时间分布
