CMDCAS是The Canadian Medical Devices Conformity Assessment System的简写。加拿大卫生部(Health Canada)要求所有进入加拿大市场销售的医疗器械制造商要有CMDCAS认证证书,以证明符合加拿大的医疗器械法规。
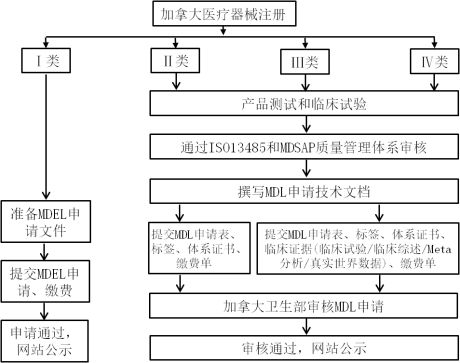
加拿大将医疗器械按产品风险程度分为四个(I, II, III, IV)风险等级。所有风险等级的医疗器械在加拿大销售,都必须获得医疗器械营业许可证Medical Device Establishment Licence(MDEL)。其中I类豁免MDL申请,I类只需要申请MDEL,而II类, III类和IV类医疗器械申请医疗器械注册证Medical Device Licence(MDL)。
Ⅱ、Ⅲ和Ⅳ类器械生产企业在申请MDL时,需要先通过MDSAP(Medical Device Single Audit Program)审核。
流程图:
通用法规:
Medical Devices Regulations(SOR/98-282)
Guidance on Medical Device Establishment Licensing
ManagementofApplicationsforMedicalDeviceLicences
官方时间和费用:
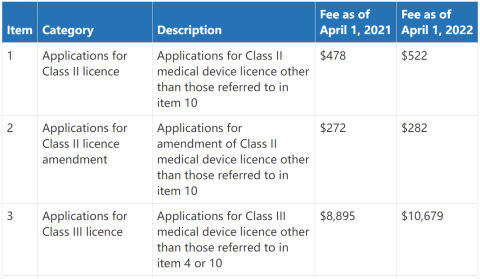
1、Ⅱ、Ⅲ类器械MDL申请费用
2、MDEL申请费用

3、年费(销售Ⅱ、Ⅲ、Ⅳ类器械)
官方时间
CMDCAS审批时间:6个月;
相关业务:
CMDCAS技术文件代理
MDSAP质量体系辅导