日本的药品和医疗器械管理是由卫生劳动和福利部(日本厚生省)(Ministry of Health,Labor and Welfare,MHLW)来负责。药品医疗器械综合管理机构(Pharmaceuticals and Medical Devices Agency,PMDA)对医疗器械进行技术复核和相关研究工作。
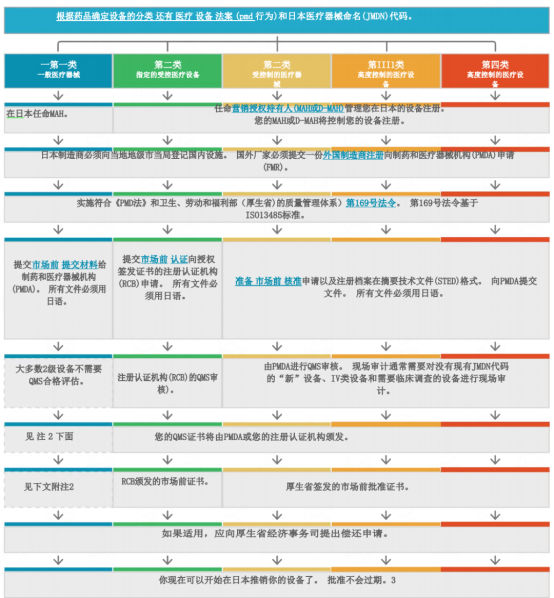
根据医疗器械风险将产品分为四类。
第1类是一般医疗设备(上市前提交Todokede),认为即使发生不良事件,对人体的风险也极低的产品,如手术刀、体外诊断设备等无需批准等。
第2类为管制医疗设备(上市前认证Ninsho),认为即使发生不良事件,对人体的风险也比较低的产品,如电子内窥镜、消化器官用导管等。不需经过PMDA审查,由授权的第三方认证机构对其与标准的符合性进行认证。
第3类为高度管制医疗设备(上市前批准Shonin),认为在发生不良事件时,对人体的风险比较高的产品。如透析器、人工骨骼、人工呼吸器、心脏血管用球囊导管等,要经过厚生劳动大臣批(PMDA审查)。
第4类为高度管制医疗设备(上市前批准Shonin),是对患者的侵入性高、在发生不良事件的情况下有可能直接导致生命危险的产品,如起博器、人工心脏、支架等。要经过厚生劳动大臣批准(PMDA审查) 。
流程图:
通用法规:
Pharmaceuticals and Medical Devices Act (PMD Act)MHLW Ministerial Ordinance No. 169-Ordinance on Standards for Manufacturing Control and Quality Control of Medical Devices and In Vitro Diagnostic Reagents
官方时间和费用:
官方时间
PMDA审批时间:8个月;
官方费用
以官方公布的价格为准;
相关业务:
PMDA认证申请
JGMP质量体系辅导
日代MAH服务