MDSAP医疗器械单一审核程序(Medical Device Single Audit Program))是由国际医疗器械监管者论坛(IMDRF)的成员共同发起的项目,旨在通过第三方审核机构,对医疗器械生产商进行一次审核即或满足参与国不同的QMS/GMP要求。
通过MDSAP审核的企业和组织,可以借助单一审核进入多元市场。目前该项目已经获得美国食药品监督管理局FDA、加拿大卫生局Health Canada、澳大利亚TGA、巴西卫生局ANVISA和日本厚生劳动省MHLW的认可。 2018年12月起进入加拿大市场必须通过MDSAP。
参加对象:
管理者代表
总工程师
研发经理
质量经理
产品注册专员
标准和法规工程师
风险管理工程师
项目经理
研发工程师
工艺工程师
质量工程师
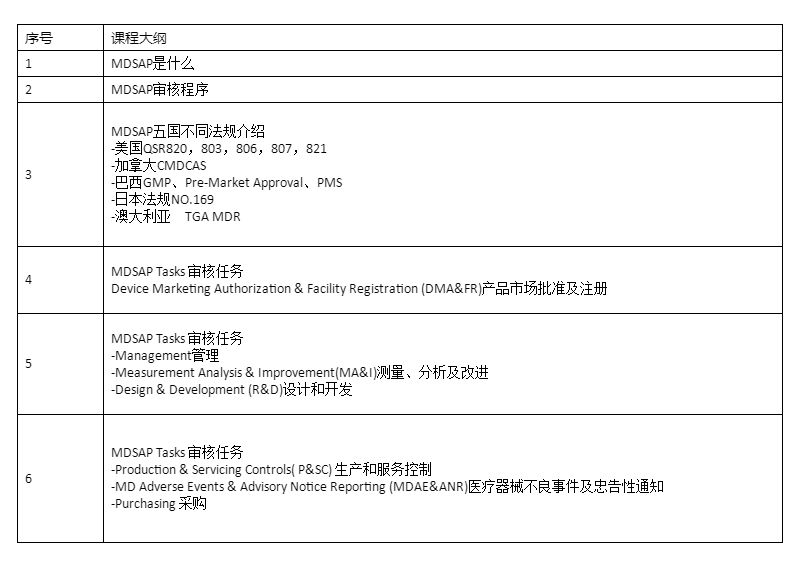
课程大纲: