2021年1月1日起,英国将开始使用UKCA认证标识,在2023年6月30日之前,英国继续接受带有CE标识的器械,从2023年7月1日开始,投放英国市场的新器械必须符合UKCA的标识要求。不适用于北爱尔兰。在北爱尔兰销售的器械需要CE标识或CE UKNI标识。
上市流程可以分为两步:
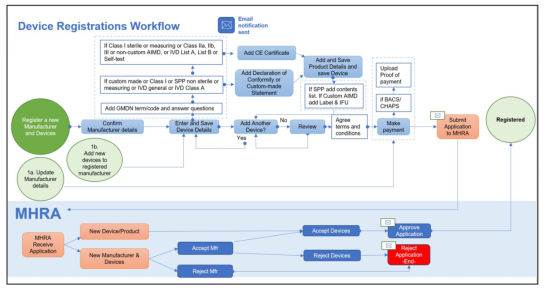
1、申请UKCA标识:由制造商进行。制造商按照产品适用的指令和法规,选择相应的符合性评估途径,编写产品技术文件,进行UKCA认证(限英国的公告机构);
2、进行MHRA备案:由英国负责人进行。从2021年1月1日起,非英国制造商,必须指定英国代理人(UK Responsible Person)。英国代理人根据相关法规,向MHRA申请医疗器械备案。备案时间表如下:
2021年5月1日前:适用于III类器械、IIb类可植入器械、有源可植入器械和IVD List A器械;
2021年9月1日前:适用于IIb类不可植入器械、IIa类器械、IVD List B器械和自我检测IVD;
2022年1月1日前:适用于I类器械、定制器械、自我声明的IVD、系统和程序包。
流程图:
通用法规:
93/42/EEC指令(MDD)
90/385/EEC指令(AIMDD)
98/79/EC指令(IVDD)
官方时间和费用:
官方时间
UKCA审批时间:6个月;
官方费用
以公告机构的价格为准
MHRA备案费:100英磅
相关业务:
UKCA技术文件代理
ISO13485质量体系辅导
英国代理人服务