(Unique Device Identification,缩写UDI)作为可以明确地识别市场上的特定医疗器械的编码,作用贯穿器械产品的全生命周期。其所具有的可识别和跟踪产品历史、分销、位置和使用其概况的能力,以及其给医疗行业个相关方所带来的可提升注册和监管效率、提升供应链效率、提高卫生系统管理效率、为患者或医生提供更高质量的信息、改进有关护理质量和成本的数据统计和促进系统内和跨系统的信息传输等特点,使得其被全球许多国家强制要求应用。
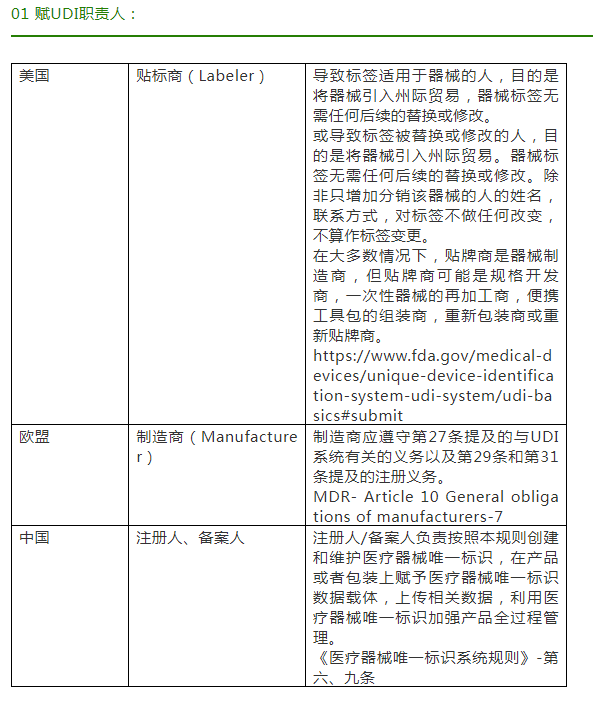
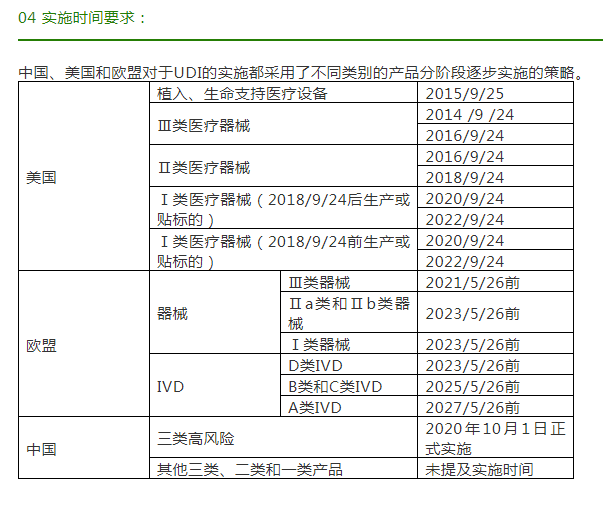
医疗器械唯一标识是根据国际或等同转换的国家物品编码标准系统,采用数字或字母表示的代码。这个代码按照医疗器械追溯的要求构成,在全球范围内是一个特定的医疗器械的唯一标识,用于识别上市后需要追溯的医疗器械产品。它在‘IMDRFIMDRF UDI Guidance’ 中被定义为:通过全局接受的设备标识和编码标准创建的一系列数字或字母数字字符,可明确的识别市场上的特定医疗设备,主要包含产品标识(DI)和生产标识(PI)两部分。鉴于UDI所具有的唯一性、稳定性、可扩展性、可追溯性、惠及多方等特点,美国、欧盟和中国,三个国家均前后基于国际医疗器械监管机构论坛提出的《UDI应用指南》分别对UDI在医疗器械方面的实施提出了要求。现对这三个国家UDI实施的基本要求进行差异性的对比,如下: